近日,我院宋彦龄教授和上海交通大学杨洋研究员合作,在新冠病毒感染机制研究领域取得新进展,相关成果以"Elucidating the effect of nanoscale receptor-binding domain organization on SARS-CoV-2 infection and immunity activation with DNA origami"为题,发表于《美国化学会志》(J. Am. Chem .Soc. DOI:10.1021/jacs.2c09229)。
自新冠肺炎疫情暴发以来,宋彦龄研究组致力于研发中和适体以阻断新冠病毒侵染,并取得了系列研究进展(Anal. Chem. 2020, 92 (14), 9895-9900;Angew. Chem., Int. Ed. 2021, 60 (18), 10266-10272;J. Am. Chem. Soc. 2021, 143 (51), 21541–21548;2022, 144 (29), 13146-13153; ACS Nano 2022, 16 (9), 15310−15317)。
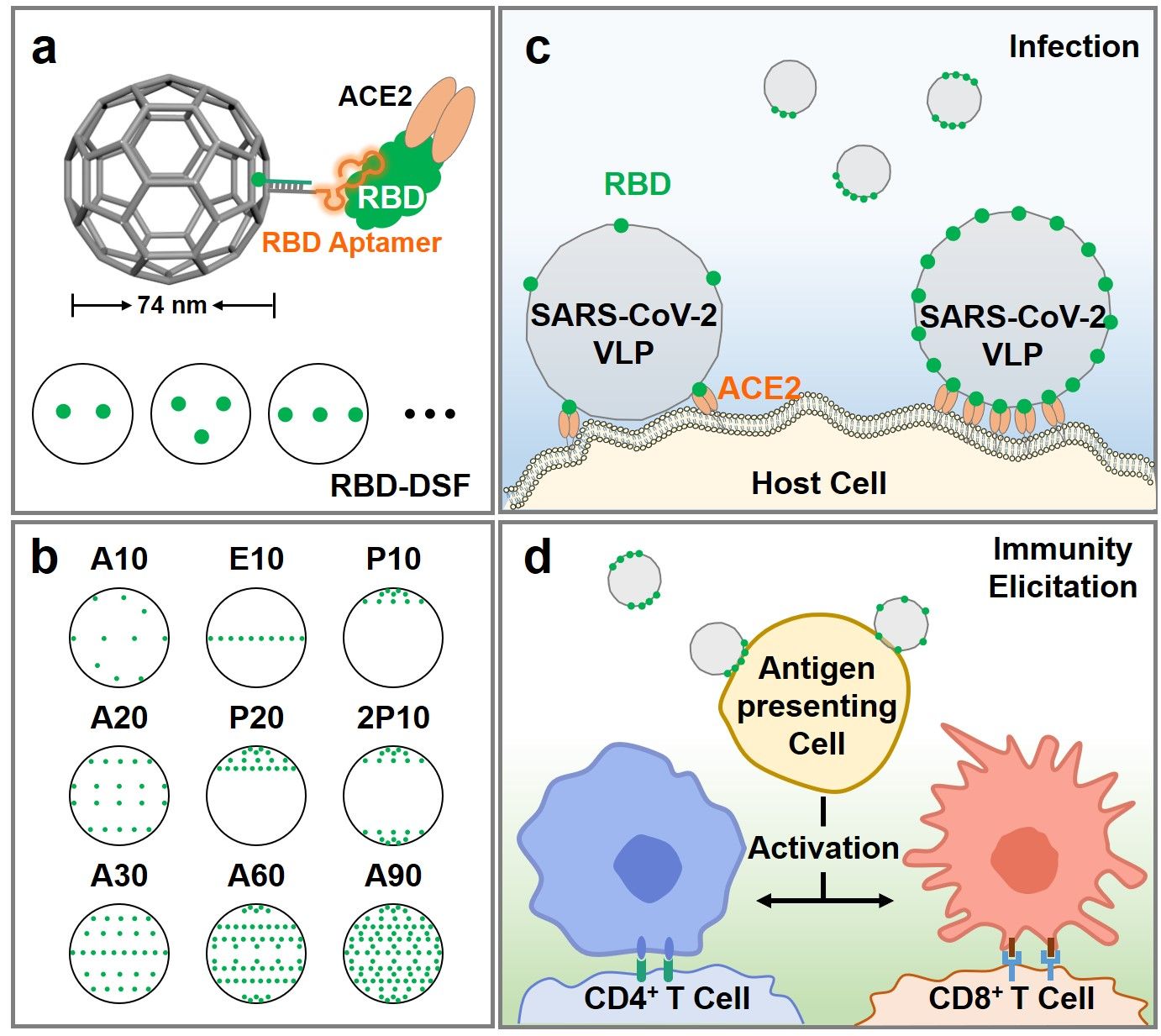
自然界存在丰富的多价受体-配体相互作用,不同病毒在配体数量和拓扑分布展现出不同特征,以平衡侵染效率和能量消耗。以包膜病毒为例,其与宿主细胞通过多价作用实现病毒侵染。然而,不同包膜病毒在刺突蛋白(Spike)分布(数量、间距、几何图案)上呈现显著差异,从而导致不同的感染特性。例如,SARS-CoV-2上的Spike蛋白/受体结合域(RBD)分布远比流感病毒的稀疏,却能引起更为严重且持续的全球疫情大流行。尽管结构生物学家已经获得了单个Spike/RBD-ACE2的晶体结构,然而由RBD的数量和分布模式引起的病毒侵染和免疫刺激反应的差异尚不清楚。因此,亟需获得一个具有空间精确抗原排布的类病毒颗粒,以探究具有不同抗原个数和分布模式的病毒是如何实现高效感染和免疫激活。
为此,该工作通过DNA折纸技术构建了具有空间精确RBD排布的SARS-CoV-2病毒样颗粒(SARS-CoV-2 VLP)以模拟天然病毒。为了保留更多的RBD蛋白上的活性位点,采取团队前期发展的靶向RBD非ACE2结合区域的CoV2-4C核酸适体,从而更准确地模拟病毒-宿主细胞的相互作用和免疫反应。首先,通过CoV2-4C核酸适体引导,将RBD排布在直径约74 nm的DNA足球框架上,进行SARS-CoV-2 VLP和受体细胞的结合动力学、热力学性质的系统分析。研究发现,SARS-CoV-2 VLP和宿主细胞结合的亲和力、结合速率随着RBD数目的增加而增加;RBD集中分布比均匀分布具有与宿主细胞更强、更快的结合热力学和动力学特征。此外,免疫激活程度并不随着RBD个数增加而线性增加。每个SARS-CoV-2 VLP上仅需20个均匀分布的RBD就能实现巨噬细胞高达86%的免疫激活。总之,这项工作为研究SARS-CoV-2感染机制和类病毒颗粒疫苗的免疫激活提供了一个新工具。
该工作在我院宋彦龄教授和上海交通大学杨洋研究员的共同指导下完成。我院2021级博士生张佳露和上海交通大学医学院附属仁济医院检验科博士后徐芸芸为论文的共同第一作者。我院杨朝勇教授为该研究提供了宝贵的意见。研究工作得到国家自然科学基金项目(22022409、21735004、21874089、21977069)等资助。
论文链接:https://doi.org/10.1021/jacs.2c09229
