我院黄培强教授课题组在酰胺不对称还原官能化方面取得重要进展,相关成果以“Multicatalysis protocol enables direct and versatile enantioselective reductive transformations of secondary amides”为题发表于《科学进展》(Science Advances, 2022, 8, eade3431)。
手性胺是一类重要有机化合物,很多具有生物活性的生物碱、药物分子和手性催化剂中都含有这一结构单元。酰胺是一类价廉易得且性质稳定的化合物,在有机合成和药物化学中被广泛用作原料、中间体和胺的保护形式。酰胺基还是C-H键活化的重要导向基团。然而,由于酰胺是羧酸衍生物中亲电性最低的物种之一,酰胺的直接转化具有很大的挑战性。自2010年黄培强教授课题组报道普适性的叔酰胺直接还原双烷基化反应(Angew. Chem. Int. Ed. 2010, 49, 3037)和还原烷基化反应(Chem.- Eur. J. 2010, 16, 12792)以来,以C-C键形成为特征的酰胺直接转化引起国内外诸多课题组的兴趣,多个课题组相继发展了酰胺的还原官能化方法。近年来,过渡金属催化的酰胺还原官能化得到了蓬勃发展。2018年,黄培强教授课题组发展了金属催化的仲酰胺还原烷基化(Angew. Chem. Int. Ed. 2018, 57, 11354)。然而,酰胺的催化不对称转化方面却进展缓慢,仅有黄培强课题组于2021年报道了采用金属铱与手性硫脲串联催化的仲酰胺的不对称还原氰基化/膦酰化反应(Angew. Chem. Int. Ed. 2021, 60, 8827);同年,中科院上海有机所王晓明研究员课题组与黄培强教授课题组合作发展了叔苯甲酰胺衍生物的对映选择性催化还原炔化方法(Angew. Chem. Int. Ed. 2021, 60, 26604)。尽管取得了这些重要进展,仲酰胺的催化不对称还原炔基化和还原烷基化仍无法实现。
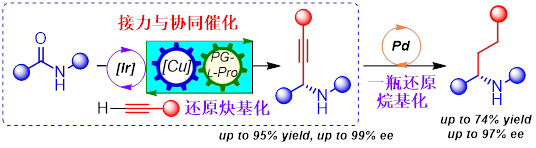
近日,黄培强教授课题组首次报道了仲酰胺的催化还原/脱氧不对称炔基化、烷基化反应。该方法基于将铱/铜双金属接力催化与有机小分子催化相结合的多重催化策略,实现了仲酰胺的催化不对称还原炔基化,以及原位与钯催化氢化反应结合进行仲酰胺催化一瓶对映选择性还原烷基化。该催化还原不对称炔基化方法对多数底物具有优良的收率和对映选择性(up to 95% yield, up to 99% ee),表现出优异的化学选择性和官能团耐受性,可兼容酮和醛等反应性更高的官能团。通过这一新策略,课题组高效地合成了活性药物分子中常见的四种α-支链手性胺结构片段,实现了两种药物衍生物的后期官能化和阿片受体拮抗剂阿替卡普兰(Aticaprant)的首次催化不对称合成,从而展示了该方法的在有机合成和药物合成中的实用性。
该研究工作在黄培强教授指导下完成,博士研究生陈航、硕士研究生吴志忠为论文第一作者,硕士研究生邵东阳参与部分工作。研究工作得到国家自然科学基金重点项目(21931010)和国家重点研发计划(2017YFA0207302)的资助。
论文链接:https://www.science.org/doi/10.1126/sciadv.ade3431
